Педиатрия №03 2019 - Селективный дефицит иммуноглобулина A в практике педиатра
07 января 2020 | 15:07:06
24931
0
Аннотация
Селективный дефицит иммуноглобулина (Ig) А является наиболее распространенным первичным иммунодефицитным состоянием. В большинстве случаев заболевание протекает бессимптомно, у остальных больных клинические проявления могут включать в себя рецидивирующие инфекционные, аллергические и аутоиммунные заболевания. Раннее выявление селективного дефицита IgA может определить патогенетическое обоснование частого возникновения инфекционных и рефрактерного течения атопических заболеваний, способствовать своевременной корректной диагностике ассоциированных с первичным иммунодефицитным состоянием патологий, а также предотвратить развитие тяжелых анафилактических реакций на переливание препаратов крови. В статье представлены данные о структуре и функциях IgA в организме, определены патогенетические механизмы развития его дефицита, проанализированы клинические проявления заболевания. Обзор литературных данных дополнен обсуждением двух клинических случаев, демонстрирующих значение своевременной диагностики дефицита IgA.
Ключевые слова: дети, первичные иммунодефицитные состояния, иммуноглобулин А, селективный дефицит иммуноглобулина А, атопические заболевания, респираторные инфекции, кишечные инфекции, аутоиммунная патология, целиакия, микробиота.
Для цитирования: Дмитриева Ю.А., Захарова И.Н., Радченко Е.Р. Селективный дефицит иммуноглобулина A в практике педиатра. Педиатрия. Consilium Medicum. 2019; 3: 122–126. DOI: 10.26442/26586630.2019.3.190633
Best Practice
1Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2Dmitriy Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology,
Moscow, Russia;
3Baslyaeva Children's City Clinical Hospital, Moscow, Russia
*jadmitrieva@mail.ru
Abstract
Selective IgA deficiency is the most common primary immunodeficiency disorder. Most patients with IgA deficiency are asymptomatic, other patients can develop recurrent infectious, allergic and autoimmune diseases. Early detection of selective IgA deficiency can determine the pathogenetic reasoning of frequent infectious and refractory course of atopic diseases, contribute to the timely correct diagnosis of disorders associated with the primary immunodeficiency, and also prevent the development of severe anaphylactic reactions to blood transfusion. The article provides data on IgA structure and functions, determines the pathogenetic mechanisms of its deficiency, and analyzes the clinical manifestations of the disease. A literature review is complemented by a discussion of two clinical cases demonstrating the importance of timely diagnosis of IgA deficiency.
Key words: children, primary immunodeficiency disorders, immunoglobulin A, selective IgA deficiency, atopic diseases, respiratory infections, intestinal infections, autoimmune pathology, celiac disease, microbiota.
For citation: Dmitrieva Iu.A., Zakharova I.N., Radchenko E.R. Selective IgA deficiency in pediatrician practice. Pediatrics. Consilium Medicum. 2019; 3: 122–126. DOI: 10.26442/26586630.2019.3.190633
Селективный дефицит иммуноглобулина (Ig) A определяется как отсутствие или снижение уровня IgA в сыворотке ниже 7 мг/дл (0,07 г/л) при нормальной концентрации IgG и IgM у пациентов старше 4 лет и при условии исключения иных причин гипогаммаглобулинемии [1]. Возрастные ограничения при постановке диагноза определяются тем, что у детей раннего возраста может отмечаться транзиторный дефицит, обусловленный замедленным становлением системы IgA после рождения.
Селективный дефицит IgA является наиболее распространенным первичным иммунодефицитным состоянием. Распространенность заболевания имеет регионарные различия и, по отдельным данным, достигает 1:143 у жителей Аравийского полуострова, 1:163 в Испании, 1:875 в Англии, 1:965 в Бразилии. В целом считается, что частота селективного дефицита IgA выше среди европейского населения – в среднем 1:500, в то время как в азиатских странах распространенность фиксируется на порядок ниже – 1:2600–5300 в Китае, 1:14 840–18 500 в Японии [2, 3]. Стоит отметить, что истинная частота заболевания может быть выше, поскольку у части больных заболевание протекает бессимптомно, в то же время скрининговые программы по выявлению данного состояния до настоящего времени активно не проводятся.
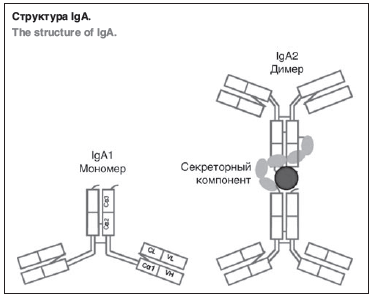 IgA является наиболее активно вырабатываемым Ig в организме человека и вторым по содержанию изотипом в сыворотке крови, уступая по уровню лишь IgG [2,4]. В системной циркуляции IgA присутствует в форме мономера (IgA1), в то время как секреторный IgA (sIgA) в составе слизистого секрета респираторного, желудочно-кишечного и урогенитального трактов представлен в виде димера (IgA2) [5].
IgA является наиболее активно вырабатываемым Ig в организме человека и вторым по содержанию изотипом в сыворотке крови, уступая по уровню лишь IgG [2,4]. В системной циркуляции IgA присутствует в форме мономера (IgA1), в то время как секреторный IgA (sIgA) в составе слизистого секрета респираторного, желудочно-кишечного и урогенитального трактов представлен в виде димера (IgA2) [5].
Структура IgA-мономера в сыворотке крови (IgA1) включает две тяжелые цепи, каждая из которых содержит один вариабельный и три стабильных региона. Роль сывороточного IgA в реализации системного иммунного ответа требует дальнейшего изучения. IgA не приводит к активации комплемента по классическому пути, при этом он способен активировать фагоцитарную систему посредством связывания с FcRa-рецепторами на поверхности моноцитов и гранулоцитов, что способствует элиминации чужеродных антигенов [6]. sIgA-димер составляет 2/3 от всего количества IgA, синтезируемого в организме. Принципиальным отличием sIgA2-димера является наличие секреторного компонента, синтезируемого эпителиальными клетками слизистых оболочек (СО) и присоединяющегося к молекуле IgA в момент ее прохождения через эпителиальные клетки (см. рисунок). Данный компонент обеспечивает большую устойчивость sIg к бактериальным протеазам на поверхности респираторного и желудочно-кишечного тракта (ЖКТ) [2, 7, 8]. Более 95% sIgA продуцируется локально. В ЖКТ основными местами синтеза являются Пейеровы бляшки, изолированные лимфоидные фолликулы, а также неорганизованные лимфоидные структуры собственной пластинки СО [9].
Общая площадь СО организма достигает 200–400 м2. Представители микробиоценоза СО, общее количество которых достигает 15–36 тыс. микробных клеток, покрыты sIgA, который предотвращает проникновение микроорганизмов через эпителиальный барьер. Защитное действие sIgA опосредуется связыванием микроорганизмов с его антигенспецифичными Fab-участками. Кроме того, обсуждается роль N- и O-гликанов в структуре sIgA, также способных связываться с рецепторами вирусов и бактериальных клеток, что может усиливать защитные свойства IgА [10, 11].
Антиинфекционные свойства sIgA обеспечиваются несколькими механизмами. В ЖКТ он способен распознавать различные антигенные эпитопы в структуре вирусов, бактерий и простейших, связывать их на поверхности кишечного эпителия, тем самым предотвращая их проникновение во внутреннюю среду организма [12]. Аналогичный механизм защиты действует в отношении различных токсинов и пищевых аллергенов. В экспериментах на животных пероральное введение sIgA обеспечивало защитный эффект в отношении таких возбудителей кишечных инфекций, как Salmonella typhimurium, Shigella flexneri и Helicobacter pylori [13–15]. В исследованиях in vitro с использованием культур эпителиальных клеток было показано, что IgA может ингибировать действие токсинов Vibrio cholera и Clostridium difficile, препятствуя повреждению эпителиоцитов [16, 17]. Доказан протективный эффект sIgA в отношении ВИЧ, заключающийся в предотвращении проникновения вируса через СО ЖКТ в системную циркуляцию [18].
Наряду с эффективной антиинфекционной защитой, реализующейся на поверхности эпителиального барьера, sIgA способен нейтрализовать патогены как внутри энтероцитов, так и на уровне собственной пластинки СО. Механизм действия заключается в связывании патогена на разных этапах его проникновения с последующим выведением в просвет кишечника в процессе естественного механизма секреции [12]. Свободный секреторный компонент IgА способен самостоятельно оказывать защитную функцию, связывая антигены на поверхности СО кишечника. В ходе ряда исследований данный эффект был продемонстрирован в отношении токсина A C. difficile и интимина энтеропатогенной Escherichia coli [19].
sIgA обладает способностью селективно связываться с рецепторами апикальных мембран М-клеток в структуре Пейеровых бляшек и проникать через эпителиальный барьер. Дальнейшая презентация антигенов в комплексе с sIgA наивным Т-лимфоцитам Пейеровых бляшек и регионарных лимфатических узлов инициирует развитие Тh2-иммунного ответа с последующим ослаблением воспалительного процесса. В то же время ретроградное проникновение sIgA через эпителиальный барьер в комплексе с антигенами бактерий-комменсалов определяет формирование к ним иммунной толерантности путем активации регуляторных Т-лимфоцитов [12]. Связывание липополисахаридов грамотрицательных бактерий с sIgA способствует их нейтрализации в структуре эндосом эпителиоцитов, что препятствует NF-kB-инициированной активации экспрессии генов, обладающих провоспалительной активностью, и способствует сохранению целостности кишечного барьера [12, 20].
Основным патогенетическим механизмом развития первичного селективного дефицита IgA является нарушение терминального этапа дифференцировки IgA-позитивных В-лимфоцитов [4]. Секреторный компонент при этом остается интактным, что указывает на то, что механизм эпителиального транспорта у пациентов не нарушен. В системной циркуляции и СО ЖКТ отмечается уменьшение количества IgA-продуцирующих плазмоцитов, при этом в кишечнике имеет место их замещение IgM- и IgG-несущими клетками [3]. В процессе диагностики необходимо принимать во внимание, что дефицит IgA может отмечаться в составе других первичных иммунодефицитных состояний (атаксия-телеангиэктазия Луи-Бар, гипер-IgM-синдром, дефицит субклассов IgG, общая вариабельная иммунная недостаточность и др.), а также сопровождать терапию определенными препаратами (антиконвульсанты, нестероидные противовоспалительные препараты, кортикостероиды, пеницилламин, сульфасалазин, фенитоин и др.) [3].
Несмотря на решающую роль sIgA в обеспечении защитных антиинфекционных механизмов, у 85–90% больных селективным дефицитом IgA заболевание протекает бессимптомно. Объясняется это тем, что диагностика иммунодефицитного состояния основывается на определении уровня сывороточного IgA, при этом sIgA обычно не исследуется. Соответственно, можно предполагать, что часть пациентов с селективным дефицитом IgA все же имеют определенный уровень sIgA в составе секрета СО, что позволяет поддерживать защитную функцию. Кроме того, у ряда больных с дефицитом IgA часто отмечается повышение продукции IgМ, который способен компенсировать недостающую защитную функцию ввиду структурного и функционального свойства с IgA [2]. Клинические проявления селективного дефицита IgA могут включать в себя рецидивирующие инфекционные, аллергические и аутоиммунные заболевания, повышенный риск развития злокачественных новообразований ЖКТ.
Рецидивирующие инфекционные заболевания ЛОР-органов и респираторного тракта являются наиболее частым клиническим проявлением селективного дефицита IgA, основными патогенами при этом являются Haemophilus influenzae и Streptococcus pneumoniae [2, 7, 21]. Аналогичным образом пациенты с селективным дефицитом IgA подвержены паразитарным инвазиям и инфекционным заболеваниям ЖКТ [4]. Хорошо известна ассоциация дефицита IgA с лямблиозом, развитие которого обусловлено более благоприятными условиями для адгезии и пролиферации Giardia lamblia на поверхности кишечного эпителия в условиях снижения защитных свойств СО [22].
Пациенты с селективным дефицитом IgA более подвержены аллергическим заболеваниям [21]. В исследовании A. Aghamohammadi и соавт. (2009 г.) было продемонстрировано, что более 80% больных (в возрасте от 4 до 32 лет) имели аллергические заболевания, включая бронхиальную астму, атопический дерматит, аллергический ринит/конъюнктивит, крапивницу, лекарственную или пищевую аллергию [23]. При этом у 40,5% пациентов именно аллергические состояния явились основным клиническим проявлением селективного дефицита IgA. Одним из патогенетических механизмов данной ассоциации является активное проникновение аллергенов в субэпидермальные и подслизистые слои респираторного тракта и ЖКТ в условиях недостаточной элиминации макромолекул и пептидов с поверхности СО. Данный процесс является пусковым фактором продукции специфических антител к отдельным аллергенам с формированием сенсибилизации и, в частности, пищевой непереносимости [2].
К наиболее тяжелым проявлениям селективного дефицита IgA относятся различные аутоиммунные заболевания (см. таблицу) [2, 3]. Стоит отметить, что даже в отсутствие клиники аутоиммунного заболевания в сыворотке больных часто выявляются различные аутоантитела [24].
В исследовании E. Edwards и соавт. (2004 г.) было продемонстрировано, что аутоиммунные заболевания явились второй по частоте патологией, ассоциированной с селективным дефицитом IgA, после инфекций [25]. Наиболее часто аутоиммунные заболевания отмечались у взрослых пациентов (средний возраст 29 лет) женского пола. В группу наиболее частых заболеваний попали идиопатическая тромбоцитопеническая пурпура с последующим развитием гемолитической анемии, ювенильный ревматоидный артрит, тиреоидит, системная красная волчанка, а также присутствие в сыворотке крови аутоантител в отсутствие клинической манифестации. В младшем возрасте аутоиммунные заболевания отмечались у 19% пациентов и включали в себя аутоиммунные заболевания щитовидной железы, целиакию, анемию и системную красную волчанку.
Частота селективного дефицита IgA среди больных целиакией достигает 1:200 [26]. С учетом того, что диагностика целиакии строится на определении в сыворотке крови специфических для заболевания аутоантител класса IgA (антитела к тканевой трансглутаминазе – анти-ТТГ – и эндомизию), оценка исходного уровня IgА в сыворотке является обязательной в рамках первичного серологического скрининга на целиакию. При выявлении дефицита IgA необходимым является определение указанных антител класcа IgG в сочетании с качественной морфологической диагностикой для верификации диагноза [27].
 В группу часто ассоциированных с селективным дефицитом IgA патологических состояний также входят воспалительные заболевания кишечника, преимущественно язвенный колит [28].
В группу часто ассоциированных с селективным дефицитом IgA патологических состояний также входят воспалительные заболевания кишечника, преимущественно язвенный колит [28].
Больные с селективным дефицитом IgA могут вырабатывать анти-IgA-антитела класса IgE, которые могут стать причиной развития тяжелых анафилактических реакций при переливании препаратов крови. Определение данных антител является важным критерием прогнозирования развития осложнений гемотрансфузии, однако на практике исследование не является повсеместно доступным, а соответственно, используется редко. Оптимальным для больных селективным дефицитом IgA является переливание крови от IgA-дефицитного донора. При невозможности соблюдения оптимальных условий введение любых препаратов крови больным с селективным дефицитом IgA должно проводиться с высокой осторожностью [2].
Бессимптомные пациенты с селективным дефицитом IgA терапии не требуют. В случае клинически манифестных форм заболевания основная тактика заключается в своевременном выявлении и лечении ассоциированных заболеваний и патологических состояний. C целью демонстрации вариабельной клинической картины, диагностического подхода и терапевтической тактики приводим демонстрацию двух клинический наблюдений из собственной практики.
Из анамнеза: ребенок от повторной физиологически протекавшей беременности, срочных родов. Грудное вскармливание до 3 мес, далее перевод на вскармливание стандартными адаптированными смесями; продукты прикорма в рационе с 5 мес. Аллергических реакций, изменений характера стула в период искусственного вскармливания и на этапе введения прикорма не отмечалось. До 3,5 года девочка росла и развивалась по возрасту, инфекционными заболеваниями болела редко, в весе прибавляла достаточно. Дебют СД в 3 года 11 мес. Несмотря на неоднократно проводимую коррекцию инсулинотерапии, в течение 8 мес добиться стабилизация показателей гликемии не удалось. В течение последнего полугодия мама стала отмечать увеличение в объеме живота ребенка, периодически учащенный кашицеобразный непереваренный стул. Девочка стала отставать в росте, появились множественный кариес молочных зубов, извращение вкуса (ребенок стал есть мел, песок), в повторных анализах крови обращало на себя внимание стойкое сохранение гипохромной микроцитарной анемии.
Клинические проявления синдрома мальабсорбции (учащенный разжиженный стул, увеличение живота в объеме), отставание ребенка в физическом развитии: рост 95 см (SDS -2,6), масса тела 14,7 кг (SDS -1,3), индекс массы тела 16,3 кг/м2 (SDS 0,77), – множественный кариес временных зубов, а также результаты проведенных лабораторных исследований, подтвердившие наличие у пациентки железодефицитной анемии средней степени тяжести (гемоглобин 85 г/л, эритроциты 4,26, средний объем эритроцита 64,1 фл, среднее содержание гемоглобина в эритроците 20 пг, железо 3 мкмоль/л, ферритин 3,03 нг/мл) и гипокальциемии (кальций общий 1,8 ммоль/л, кальций ионизированный 1,07 ммоль/л) потребовали исключения целиакии.
При первичном серологическом скрининге у ребенка было выявлено резкое снижение уровня общего IgA (менее 0,01 г/л) при нормальном сывороточном уровне Ig класса M и G. На этом фоне уровень специфических анти-ТТГ IgA определялся в пределах нормальных значений: анти-ТТГ IgA 9,8 Ед/мл (норма 0–10). В соответствии с рекомендациями Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов при повторном серологическом исследовании у пациентки был определен уровень специфических для целиакии антител класса IgG: анти-ТТГ IgG 280 Ед/мл (норма 0–10), антитела к эндомизию IgG 1:1280 (норма <1:5). При последующем исследовании биоптатов СО двенадцатиперстной кишки были выявлены морфологические признаки атрофической энтеропатии с межэпителиальным лимфоцитозом в стадии Marsh 3B.
На основании данных анамнеза, клинической картины и результатов проведенных лабораторно-инструментальных исследований был выставлен диагноз: СД 1-го типа, медикаментозная субкомпенсация. Целиакия. Первичное иммунодефицитное состояние: селективный дефицит IgA. Железодефицитная анемия средней степени тяжести.
Данный клинический пример демонстрирует наличие довольно частой ассоциации двух аутоиммунных заболеваний – СД 1-го типа и целиакии – и селективного дефицита IgА, который в данном случае протекал бессимптомно. Следует отметить, что диагноз целиакии у ребенка в данном случае был установлен поздно. На основании оценки динамики физического развития пациентки (патологическая задержка роста с возраста 3 лет – за год до развития СД) можно предполагать, что целиакия у нее стартовала первой и явилась дополнительным триггерным фактором для дебюта второго иммунноопосредованного заболевания. В то же время течение СД на фоне сохраняющейся активности целиакии определило недостаточную эффективность проводимой инсулинотерапии и лабильные показатели гликемии. Данный клинический пример также акцентирует внимание специалистов на необходимости определения уровня общего IgA сыворотки при первичном серологическом обследовании, поскольку часто ассоциируемый с целиакией селективный дефицит IgA может приводить к ложноотрицательным результатам выполняемых тестов.
Из анамнеза: с первого года жизни у ребенка отмечались проявления атопического дерматита, по поводу которого он наблюдался аллергологом, проводились местная терапия, коррекция рациона питания. С 2 лет на фоне частых инфекционных респираторных заболеваний у мальчика появились повторные эпизоды бронхообструкции. В возрасте 4 лет ребенок был впервые обследован в условиях стационара. Данные анамнеза, клиническая картина заболевания, а также результаты проведенных исследований (в том числе выявленное снижение уровня IgA сыворотки ниже 0,07 г/л) стали основанием для установления диагноза «Бронхиальная астма, среднетяжелое течение. Атопический дерматит, распространенная форма. Круглогодичный аллергический ринит. Первичное иммунодефицитное состояние: селективный дефицит IgA». До момента первичного обращения в консультативный центр мальчик непрерывно получал комбинированную базисную терапию бронхиальной астмы, однако полного контроля за заболеванием достигнуто не было: рецидивирующие эпизоды бронхообструкции отмечались как на фоне ежемесячных респираторных инфекций, так и при физической или эмоциональной нагрузке. С возраста 7 лет спектр атопических заболеваний у пациента, наряду с бронхиальной астмой и атопическим дерматитом, включал круглогодичный аллергический риноконъюнктивит. В возрасте 12 лет при плановом стационарном обследовании в связи с жалобами ребенка на частые боли в животе, отрыжку, изжогу, метеоризм было проведено эндоскопическое исследование, при котором были выявлены признаки хронического гастродуоденита (забор биоптатов СО для морфологического исследования не проводился), по поводу чего проведена терапия антацидами, ферментами, пробиотиками с положительным, но нестойким эффектом. Боли в животе и патологический характер стула упорно сохранялись и стали основанием для повторного гастроэнтерологического обследования.
Стойкий абдоминальный синдром в сочетании с выявленной у пациента при первичном осмотре недостаточностью питания: рост 174 см, масса тела 57 кг, индекс массы тела 17,9 кг/м2 (SDS -2), – а также наличие сопутствующего иммунодефицитного состояния стали основанием для исключения у ребенка целиакии. Учитывая верифицированный ранее селективный дефицит IgA в ходе первичного серологического исследования был определен уровень специфических анти-ТТГ IgG>100 Ед/мл (норма 0–10). При исследовании биоптатов СО двенадцатиперстной кишки была выявлена атрофическая энтеропатия с межэпителиальным лимфоцитозом в стадии Marsh 3A–3B.
На основании данных анамнеза, клинической картины и результатов проведенных лабораторно-инструментальных исследований был выставлен диагноз «Целиакия. Бронхиальная астма, атопическая, среднетяжелое течение, межприступный период. Атопический дерматит, распространенный, эритематозно-сквамозная форма, средней степени тяжести, непрерывно рецидивирующее течение. Круглогодичный аллергический ринит, обострение. Первичное иммунодефицитное состояние: селективный дефицит IgA. Недостаточность питания».
Данный клинический пример демонстрирует ассоциацию селективного дефицита IgA с целиакей. Доминирующими проявлениями первичного иммунодефицитного состояния в данном случае явились атопические заболевания и повторные респираторные инфекции, отмечавшиеся у пациента преимущественно в младшем возрасте. Стоит отметить, что первые жалобы на боли в животе и эпизоды разжиженного стула у мальчика появились в возрасте 5 лет и в течение последующего десятилетия не насторожили специалистов в отношении возможности наличия целиакии в ассоциации с селективным дефицитом IgA. Несвоевременная диагностика заболевания определила стойкое сохранение абдоминального синдрома, резкое снижение качества жизни пациента и недостаточный комплаенс в отношении диетотерапии после установления диагноза целиакии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Дмитриева Юлия Андреевна – канд. мед. наук, доц. каф. педиатрии с курсом поликлинической педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО, врач-гастроэнтеролог ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева». E-mail: jadmitrieva@mail.ru
Iuliia A. Dmitrieva – Cand. Sci. (Med.), Russian Medical Academy of Continuous Professional Education, Dmitriy Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology. E-mail: jadmitrieva@mail.ru
Захарова Ирина Николаевна – д-р мед. наук, проф., зав. каф. педиатрии с курсом поликлинической педиатрии им. Г.Н. Сперанского ФГБОУ ДПО РМАНПО, засл. врач РФ. E-mail: zakharova-rmapo@yandex.ru; ORCID: https://orcid.org/0000-0003-4200-4598
Irina N. Zakharova – D. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education. E-mail: zakharova-rmapo@yandex.ru;
ORCID: https://orcid.org/0000-0003-4200-4598
Радченко Елена Равильевна – врач-гастроэнтеролог 1-го педиатрического отд-ния ГБУЗ «ДГКБ им. З.А. Башляевой»
Elena R. Radchenko – gastroenterologist, Baslyaeva Children's City Clinical Hospital
Статья поступила в редакцию / The article received: 15.08.2019
Статья принята к печати / The article approved for publication: 01.10.2019
Селективный дефицит иммуноглобулина (Ig) А является наиболее распространенным первичным иммунодефицитным состоянием. В большинстве случаев заболевание протекает бессимптомно, у остальных больных клинические проявления могут включать в себя рецидивирующие инфекционные, аллергические и аутоиммунные заболевания. Раннее выявление селективного дефицита IgA может определить патогенетическое обоснование частого возникновения инфекционных и рефрактерного течения атопических заболеваний, способствовать своевременной корректной диагностике ассоциированных с первичным иммунодефицитным состоянием патологий, а также предотвратить развитие тяжелых анафилактических реакций на переливание препаратов крови. В статье представлены данные о структуре и функциях IgA в организме, определены патогенетические механизмы развития его дефицита, проанализированы клинические проявления заболевания. Обзор литературных данных дополнен обсуждением двух клинических случаев, демонстрирующих значение своевременной диагностики дефицита IgA.
Ключевые слова: дети, первичные иммунодефицитные состояния, иммуноглобулин А, селективный дефицит иммуноглобулина А, атопические заболевания, респираторные инфекции, кишечные инфекции, аутоиммунная патология, целиакия, микробиота.
Для цитирования: Дмитриева Ю.А., Захарова И.Н., Радченко Е.Р. Селективный дефицит иммуноглобулина A в практике педиатра. Педиатрия. Consilium Medicum. 2019; 3: 122–126. DOI: 10.26442/26586630.2019.3.190633
Best Practice
Selective IgA deficiency in pediatrician practice
Iuliia A. Dmitrieva*1,2, Irina N. Zakharova1, Elena R. Radchenko31Russian Medical Academy of Continuous Professional Education, Moscow, Russia;
2Dmitriy Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology,
Moscow, Russia;
3Baslyaeva Children's City Clinical Hospital, Moscow, Russia
*jadmitrieva@mail.ru
Abstract
Selective IgA deficiency is the most common primary immunodeficiency disorder. Most patients with IgA deficiency are asymptomatic, other patients can develop recurrent infectious, allergic and autoimmune diseases. Early detection of selective IgA deficiency can determine the pathogenetic reasoning of frequent infectious and refractory course of atopic diseases, contribute to the timely correct diagnosis of disorders associated with the primary immunodeficiency, and also prevent the development of severe anaphylactic reactions to blood transfusion. The article provides data on IgA structure and functions, determines the pathogenetic mechanisms of its deficiency, and analyzes the clinical manifestations of the disease. A literature review is complemented by a discussion of two clinical cases demonstrating the importance of timely diagnosis of IgA deficiency.
Key words: children, primary immunodeficiency disorders, immunoglobulin A, selective IgA deficiency, atopic diseases, respiratory infections, intestinal infections, autoimmune pathology, celiac disease, microbiota.
For citation: Dmitrieva Iu.A., Zakharova I.N., Radchenko E.R. Selective IgA deficiency in pediatrician practice. Pediatrics. Consilium Medicum. 2019; 3: 122–126. DOI: 10.26442/26586630.2019.3.190633
Селективный дефицит иммуноглобулина (Ig) A определяется как отсутствие или снижение уровня IgA в сыворотке ниже 7 мг/дл (0,07 г/л) при нормальной концентрации IgG и IgM у пациентов старше 4 лет и при условии исключения иных причин гипогаммаглобулинемии [1]. Возрастные ограничения при постановке диагноза определяются тем, что у детей раннего возраста может отмечаться транзиторный дефицит, обусловленный замедленным становлением системы IgA после рождения.
Селективный дефицит IgA является наиболее распространенным первичным иммунодефицитным состоянием. Распространенность заболевания имеет регионарные различия и, по отдельным данным, достигает 1:143 у жителей Аравийского полуострова, 1:163 в Испании, 1:875 в Англии, 1:965 в Бразилии. В целом считается, что частота селективного дефицита IgA выше среди европейского населения – в среднем 1:500, в то время как в азиатских странах распространенность фиксируется на порядок ниже – 1:2600–5300 в Китае, 1:14 840–18 500 в Японии [2, 3]. Стоит отметить, что истинная частота заболевания может быть выше, поскольку у части больных заболевание протекает бессимптомно, в то же время скрининговые программы по выявлению данного состояния до настоящего времени активно не проводятся.
 IgA является наиболее активно вырабатываемым Ig в организме человека и вторым по содержанию изотипом в сыворотке крови, уступая по уровню лишь IgG [2,4]. В системной циркуляции IgA присутствует в форме мономера (IgA1), в то время как секреторный IgA (sIgA) в составе слизистого секрета респираторного, желудочно-кишечного и урогенитального трактов представлен в виде димера (IgA2) [5].
IgA является наиболее активно вырабатываемым Ig в организме человека и вторым по содержанию изотипом в сыворотке крови, уступая по уровню лишь IgG [2,4]. В системной циркуляции IgA присутствует в форме мономера (IgA1), в то время как секреторный IgA (sIgA) в составе слизистого секрета респираторного, желудочно-кишечного и урогенитального трактов представлен в виде димера (IgA2) [5].Структура IgA-мономера в сыворотке крови (IgA1) включает две тяжелые цепи, каждая из которых содержит один вариабельный и три стабильных региона. Роль сывороточного IgA в реализации системного иммунного ответа требует дальнейшего изучения. IgA не приводит к активации комплемента по классическому пути, при этом он способен активировать фагоцитарную систему посредством связывания с FcRa-рецепторами на поверхности моноцитов и гранулоцитов, что способствует элиминации чужеродных антигенов [6]. sIgA-димер составляет 2/3 от всего количества IgA, синтезируемого в организме. Принципиальным отличием sIgA2-димера является наличие секреторного компонента, синтезируемого эпителиальными клетками слизистых оболочек (СО) и присоединяющегося к молекуле IgA в момент ее прохождения через эпителиальные клетки (см. рисунок). Данный компонент обеспечивает большую устойчивость sIg к бактериальным протеазам на поверхности респираторного и желудочно-кишечного тракта (ЖКТ) [2, 7, 8]. Более 95% sIgA продуцируется локально. В ЖКТ основными местами синтеза являются Пейеровы бляшки, изолированные лимфоидные фолликулы, а также неорганизованные лимфоидные структуры собственной пластинки СО [9].
Общая площадь СО организма достигает 200–400 м2. Представители микробиоценоза СО, общее количество которых достигает 15–36 тыс. микробных клеток, покрыты sIgA, который предотвращает проникновение микроорганизмов через эпителиальный барьер. Защитное действие sIgA опосредуется связыванием микроорганизмов с его антигенспецифичными Fab-участками. Кроме того, обсуждается роль N- и O-гликанов в структуре sIgA, также способных связываться с рецепторами вирусов и бактериальных клеток, что может усиливать защитные свойства IgА [10, 11].
Антиинфекционные свойства sIgA обеспечиваются несколькими механизмами. В ЖКТ он способен распознавать различные антигенные эпитопы в структуре вирусов, бактерий и простейших, связывать их на поверхности кишечного эпителия, тем самым предотвращая их проникновение во внутреннюю среду организма [12]. Аналогичный механизм защиты действует в отношении различных токсинов и пищевых аллергенов. В экспериментах на животных пероральное введение sIgA обеспечивало защитный эффект в отношении таких возбудителей кишечных инфекций, как Salmonella typhimurium, Shigella flexneri и Helicobacter pylori [13–15]. В исследованиях in vitro с использованием культур эпителиальных клеток было показано, что IgA может ингибировать действие токсинов Vibrio cholera и Clostridium difficile, препятствуя повреждению эпителиоцитов [16, 17]. Доказан протективный эффект sIgA в отношении ВИЧ, заключающийся в предотвращении проникновения вируса через СО ЖКТ в системную циркуляцию [18].
Наряду с эффективной антиинфекционной защитой, реализующейся на поверхности эпителиального барьера, sIgA способен нейтрализовать патогены как внутри энтероцитов, так и на уровне собственной пластинки СО. Механизм действия заключается в связывании патогена на разных этапах его проникновения с последующим выведением в просвет кишечника в процессе естественного механизма секреции [12]. Свободный секреторный компонент IgА способен самостоятельно оказывать защитную функцию, связывая антигены на поверхности СО кишечника. В ходе ряда исследований данный эффект был продемонстрирован в отношении токсина A C. difficile и интимина энтеропатогенной Escherichia coli [19].
sIgA обладает способностью селективно связываться с рецепторами апикальных мембран М-клеток в структуре Пейеровых бляшек и проникать через эпителиальный барьер. Дальнейшая презентация антигенов в комплексе с sIgA наивным Т-лимфоцитам Пейеровых бляшек и регионарных лимфатических узлов инициирует развитие Тh2-иммунного ответа с последующим ослаблением воспалительного процесса. В то же время ретроградное проникновение sIgA через эпителиальный барьер в комплексе с антигенами бактерий-комменсалов определяет формирование к ним иммунной толерантности путем активации регуляторных Т-лимфоцитов [12]. Связывание липополисахаридов грамотрицательных бактерий с sIgA способствует их нейтрализации в структуре эндосом эпителиоцитов, что препятствует NF-kB-инициированной активации экспрессии генов, обладающих провоспалительной активностью, и способствует сохранению целостности кишечного барьера [12, 20].
Основным патогенетическим механизмом развития первичного селективного дефицита IgA является нарушение терминального этапа дифференцировки IgA-позитивных В-лимфоцитов [4]. Секреторный компонент при этом остается интактным, что указывает на то, что механизм эпителиального транспорта у пациентов не нарушен. В системной циркуляции и СО ЖКТ отмечается уменьшение количества IgA-продуцирующих плазмоцитов, при этом в кишечнике имеет место их замещение IgM- и IgG-несущими клетками [3]. В процессе диагностики необходимо принимать во внимание, что дефицит IgA может отмечаться в составе других первичных иммунодефицитных состояний (атаксия-телеангиэктазия Луи-Бар, гипер-IgM-синдром, дефицит субклассов IgG, общая вариабельная иммунная недостаточность и др.), а также сопровождать терапию определенными препаратами (антиконвульсанты, нестероидные противовоспалительные препараты, кортикостероиды, пеницилламин, сульфасалазин, фенитоин и др.) [3].
Несмотря на решающую роль sIgA в обеспечении защитных антиинфекционных механизмов, у 85–90% больных селективным дефицитом IgA заболевание протекает бессимптомно. Объясняется это тем, что диагностика иммунодефицитного состояния основывается на определении уровня сывороточного IgA, при этом sIgA обычно не исследуется. Соответственно, можно предполагать, что часть пациентов с селективным дефицитом IgA все же имеют определенный уровень sIgA в составе секрета СО, что позволяет поддерживать защитную функцию. Кроме того, у ряда больных с дефицитом IgA часто отмечается повышение продукции IgМ, который способен компенсировать недостающую защитную функцию ввиду структурного и функционального свойства с IgA [2]. Клинические проявления селективного дефицита IgA могут включать в себя рецидивирующие инфекционные, аллергические и аутоиммунные заболевания, повышенный риск развития злокачественных новообразований ЖКТ.
Рецидивирующие инфекционные заболевания ЛОР-органов и респираторного тракта являются наиболее частым клиническим проявлением селективного дефицита IgA, основными патогенами при этом являются Haemophilus influenzae и Streptococcus pneumoniae [2, 7, 21]. Аналогичным образом пациенты с селективным дефицитом IgA подвержены паразитарным инвазиям и инфекционным заболеваниям ЖКТ [4]. Хорошо известна ассоциация дефицита IgA с лямблиозом, развитие которого обусловлено более благоприятными условиями для адгезии и пролиферации Giardia lamblia на поверхности кишечного эпителия в условиях снижения защитных свойств СО [22].
Пациенты с селективным дефицитом IgA более подвержены аллергическим заболеваниям [21]. В исследовании A. Aghamohammadi и соавт. (2009 г.) было продемонстрировано, что более 80% больных (в возрасте от 4 до 32 лет) имели аллергические заболевания, включая бронхиальную астму, атопический дерматит, аллергический ринит/конъюнктивит, крапивницу, лекарственную или пищевую аллергию [23]. При этом у 40,5% пациентов именно аллергические состояния явились основным клиническим проявлением селективного дефицита IgA. Одним из патогенетических механизмов данной ассоциации является активное проникновение аллергенов в субэпидермальные и подслизистые слои респираторного тракта и ЖКТ в условиях недостаточной элиминации макромолекул и пептидов с поверхности СО. Данный процесс является пусковым фактором продукции специфических антител к отдельным аллергенам с формированием сенсибилизации и, в частности, пищевой непереносимости [2].
К наиболее тяжелым проявлениям селективного дефицита IgA относятся различные аутоиммунные заболевания (см. таблицу) [2, 3]. Стоит отметить, что даже в отсутствие клиники аутоиммунного заболевания в сыворотке больных часто выявляются различные аутоантитела [24].
В исследовании E. Edwards и соавт. (2004 г.) было продемонстрировано, что аутоиммунные заболевания явились второй по частоте патологией, ассоциированной с селективным дефицитом IgA, после инфекций [25]. Наиболее часто аутоиммунные заболевания отмечались у взрослых пациентов (средний возраст 29 лет) женского пола. В группу наиболее частых заболеваний попали идиопатическая тромбоцитопеническая пурпура с последующим развитием гемолитической анемии, ювенильный ревматоидный артрит, тиреоидит, системная красная волчанка, а также присутствие в сыворотке крови аутоантител в отсутствие клинической манифестации. В младшем возрасте аутоиммунные заболевания отмечались у 19% пациентов и включали в себя аутоиммунные заболевания щитовидной железы, целиакию, анемию и системную красную волчанку.
Частота селективного дефицита IgA среди больных целиакией достигает 1:200 [26]. С учетом того, что диагностика целиакии строится на определении в сыворотке крови специфических для заболевания аутоантител класса IgA (антитела к тканевой трансглутаминазе – анти-ТТГ – и эндомизию), оценка исходного уровня IgА в сыворотке является обязательной в рамках первичного серологического скрининга на целиакию. При выявлении дефицита IgA необходимым является определение указанных антител класcа IgG в сочетании с качественной морфологической диагностикой для верификации диагноза [27].
 В группу часто ассоциированных с селективным дефицитом IgA патологических состояний также входят воспалительные заболевания кишечника, преимущественно язвенный колит [28].
В группу часто ассоциированных с селективным дефицитом IgA патологических состояний также входят воспалительные заболевания кишечника, преимущественно язвенный колит [28].Больные с селективным дефицитом IgA могут вырабатывать анти-IgA-антитела класса IgE, которые могут стать причиной развития тяжелых анафилактических реакций при переливании препаратов крови. Определение данных антител является важным критерием прогнозирования развития осложнений гемотрансфузии, однако на практике исследование не является повсеместно доступным, а соответственно, используется редко. Оптимальным для больных селективным дефицитом IgA является переливание крови от IgA-дефицитного донора. При невозможности соблюдения оптимальных условий введение любых препаратов крови больным с селективным дефицитом IgA должно проводиться с высокой осторожностью [2].
Бессимптомные пациенты с селективным дефицитом IgA терапии не требуют. В случае клинически манифестных форм заболевания основная тактика заключается в своевременном выявлении и лечении ассоциированных заболеваний и патологических состояний. C целью демонстрации вариабельной клинической картины, диагностического подхода и терапевтической тактики приводим демонстрацию двух клинический наблюдений из собственной практики.
Клинический пример 1
Девочка 4 лет 8 мес с установленным диагнозом «сахарный диабет (СД) 1-го типа» поступила для планового обследования в отделение эндокринологии Детской городской клинической больницы им. З.А. Башляевой с жалобами на лабильные показатели гликемии, увеличение в объеме живота, неустойчивый стул.Из анамнеза: ребенок от повторной физиологически протекавшей беременности, срочных родов. Грудное вскармливание до 3 мес, далее перевод на вскармливание стандартными адаптированными смесями; продукты прикорма в рационе с 5 мес. Аллергических реакций, изменений характера стула в период искусственного вскармливания и на этапе введения прикорма не отмечалось. До 3,5 года девочка росла и развивалась по возрасту, инфекционными заболеваниями болела редко, в весе прибавляла достаточно. Дебют СД в 3 года 11 мес. Несмотря на неоднократно проводимую коррекцию инсулинотерапии, в течение 8 мес добиться стабилизация показателей гликемии не удалось. В течение последнего полугодия мама стала отмечать увеличение в объеме живота ребенка, периодически учащенный кашицеобразный непереваренный стул. Девочка стала отставать в росте, появились множественный кариес молочных зубов, извращение вкуса (ребенок стал есть мел, песок), в повторных анализах крови обращало на себя внимание стойкое сохранение гипохромной микроцитарной анемии.
Клинические проявления синдрома мальабсорбции (учащенный разжиженный стул, увеличение живота в объеме), отставание ребенка в физическом развитии: рост 95 см (SDS -2,6), масса тела 14,7 кг (SDS -1,3), индекс массы тела 16,3 кг/м2 (SDS 0,77), – множественный кариес временных зубов, а также результаты проведенных лабораторных исследований, подтвердившие наличие у пациентки железодефицитной анемии средней степени тяжести (гемоглобин 85 г/л, эритроциты 4,26, средний объем эритроцита 64,1 фл, среднее содержание гемоглобина в эритроците 20 пг, железо 3 мкмоль/л, ферритин 3,03 нг/мл) и гипокальциемии (кальций общий 1,8 ммоль/л, кальций ионизированный 1,07 ммоль/л) потребовали исключения целиакии.
При первичном серологическом скрининге у ребенка было выявлено резкое снижение уровня общего IgA (менее 0,01 г/л) при нормальном сывороточном уровне Ig класса M и G. На этом фоне уровень специфических анти-ТТГ IgA определялся в пределах нормальных значений: анти-ТТГ IgA 9,8 Ед/мл (норма 0–10). В соответствии с рекомендациями Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов при повторном серологическом исследовании у пациентки был определен уровень специфических для целиакии антител класса IgG: анти-ТТГ IgG 280 Ед/мл (норма 0–10), антитела к эндомизию IgG 1:1280 (норма <1:5). При последующем исследовании биоптатов СО двенадцатиперстной кишки были выявлены морфологические признаки атрофической энтеропатии с межэпителиальным лимфоцитозом в стадии Marsh 3B.
На основании данных анамнеза, клинической картины и результатов проведенных лабораторно-инструментальных исследований был выставлен диагноз: СД 1-го типа, медикаментозная субкомпенсация. Целиакия. Первичное иммунодефицитное состояние: селективный дефицит IgA. Железодефицитная анемия средней степени тяжести.
Данный клинический пример демонстрирует наличие довольно частой ассоциации двух аутоиммунных заболеваний – СД 1-го типа и целиакии – и селективного дефицита IgА, который в данном случае протекал бессимптомно. Следует отметить, что диагноз целиакии у ребенка в данном случае был установлен поздно. На основании оценки динамики физического развития пациентки (патологическая задержка роста с возраста 3 лет – за год до развития СД) можно предполагать, что целиакия у нее стартовала первой и явилась дополнительным триггерным фактором для дебюта второго иммунноопосредованного заболевания. В то же время течение СД на фоне сохраняющейся активности целиакии определило недостаточную эффективность проводимой инсулинотерапии и лабильные показатели гликемии. Данный клинический пример также акцентирует внимание специалистов на необходимости определения уровня общего IgA сыворотки при первичном серологическом обследовании, поскольку часто ассоциируемый с целиакией селективный дефицит IgA может приводить к ложноотрицательным результатам выполняемых тестов.
Клинический пример 2
Пациент 15 лет обратился за консультацией с жалобами на частые боли в животе, стойкий метеоризм, разжиженный учащенный стул до 2–3 раз в день.Из анамнеза: с первого года жизни у ребенка отмечались проявления атопического дерматита, по поводу которого он наблюдался аллергологом, проводились местная терапия, коррекция рациона питания. С 2 лет на фоне частых инфекционных респираторных заболеваний у мальчика появились повторные эпизоды бронхообструкции. В возрасте 4 лет ребенок был впервые обследован в условиях стационара. Данные анамнеза, клиническая картина заболевания, а также результаты проведенных исследований (в том числе выявленное снижение уровня IgA сыворотки ниже 0,07 г/л) стали основанием для установления диагноза «Бронхиальная астма, среднетяжелое течение. Атопический дерматит, распространенная форма. Круглогодичный аллергический ринит. Первичное иммунодефицитное состояние: селективный дефицит IgA». До момента первичного обращения в консультативный центр мальчик непрерывно получал комбинированную базисную терапию бронхиальной астмы, однако полного контроля за заболеванием достигнуто не было: рецидивирующие эпизоды бронхообструкции отмечались как на фоне ежемесячных респираторных инфекций, так и при физической или эмоциональной нагрузке. С возраста 7 лет спектр атопических заболеваний у пациента, наряду с бронхиальной астмой и атопическим дерматитом, включал круглогодичный аллергический риноконъюнктивит. В возрасте 12 лет при плановом стационарном обследовании в связи с жалобами ребенка на частые боли в животе, отрыжку, изжогу, метеоризм было проведено эндоскопическое исследование, при котором были выявлены признаки хронического гастродуоденита (забор биоптатов СО для морфологического исследования не проводился), по поводу чего проведена терапия антацидами, ферментами, пробиотиками с положительным, но нестойким эффектом. Боли в животе и патологический характер стула упорно сохранялись и стали основанием для повторного гастроэнтерологического обследования.
Стойкий абдоминальный синдром в сочетании с выявленной у пациента при первичном осмотре недостаточностью питания: рост 174 см, масса тела 57 кг, индекс массы тела 17,9 кг/м2 (SDS -2), – а также наличие сопутствующего иммунодефицитного состояния стали основанием для исключения у ребенка целиакии. Учитывая верифицированный ранее селективный дефицит IgA в ходе первичного серологического исследования был определен уровень специфических анти-ТТГ IgG>100 Ед/мл (норма 0–10). При исследовании биоптатов СО двенадцатиперстной кишки была выявлена атрофическая энтеропатия с межэпителиальным лимфоцитозом в стадии Marsh 3A–3B.
На основании данных анамнеза, клинической картины и результатов проведенных лабораторно-инструментальных исследований был выставлен диагноз «Целиакия. Бронхиальная астма, атопическая, среднетяжелое течение, межприступный период. Атопический дерматит, распространенный, эритематозно-сквамозная форма, средней степени тяжести, непрерывно рецидивирующее течение. Круглогодичный аллергический ринит, обострение. Первичное иммунодефицитное состояние: селективный дефицит IgA. Недостаточность питания».
Данный клинический пример демонстрирует ассоциацию селективного дефицита IgA с целиакей. Доминирующими проявлениями первичного иммунодефицитного состояния в данном случае явились атопические заболевания и повторные респираторные инфекции, отмечавшиеся у пациента преимущественно в младшем возрасте. Стоит отметить, что первые жалобы на боли в животе и эпизоды разжиженного стула у мальчика появились в возрасте 5 лет и в течение последующего десятилетия не насторожили специалистов в отношении возможности наличия целиакии в ассоциации с селективным дефицитом IgA. Несвоевременная диагностика заболевания определила стойкое сохранение абдоминального синдрома, резкое снижение качества жизни пациента и недостаточный комплаенс в отношении диетотерапии после установления диагноза целиакии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is not conflict of interests.
Информация об авторах / Information about the authors
Дмитриева Юлия Андреевна – канд. мед. наук, доц. каф. педиатрии с курсом поликлинической педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО, врач-гастроэнтеролог ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева». E-mail: jadmitrieva@mail.ru
Iuliia A. Dmitrieva – Cand. Sci. (Med.), Russian Medical Academy of Continuous Professional Education, Dmitriy Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology. E-mail: jadmitrieva@mail.ru
Захарова Ирина Николаевна – д-р мед. наук, проф., зав. каф. педиатрии с курсом поликлинической педиатрии им. Г.Н. Сперанского ФГБОУ ДПО РМАНПО, засл. врач РФ. E-mail: zakharova-rmapo@yandex.ru; ORCID: https://orcid.org/0000-0003-4200-4598
Irina N. Zakharova – D. Sci. (Med.), Prof., Russian Medical Academy of Continuous Professional Education. E-mail: zakharova-rmapo@yandex.ru;
ORCID: https://orcid.org/0000-0003-4200-4598
Радченко Елена Равильевна – врач-гастроэнтеролог 1-го педиатрического отд-ния ГБУЗ «ДГКБ им. З.А. Башляевой»
Elena R. Radchenko – gastroenterologist, Baslyaeva Children's City Clinical Hospital
Статья поступила в редакцию / The article received: 15.08.2019
Статья принята к печати / The article approved for publication: 01.10.2019
Список исп. литературыСкрыть список1. Geha RS, Notarangelo LD, Casanova JL et al. Primary immunodeficiency diseases: an update from the International Union of Immunological Societies Primary Immunodeficiency Diseases Classification Committee. J Allergy Clin Immunol 2007; 120: 776–94.
2. Yel L. Selective IgA Deficiency. J Clin Immunol 2010; 30 (1): 10–6.
3. Latiff AH, Kerr MA. The clinical significance of immunoglobulin A deficiency. Ann Clin Biochem 2007; 44 (Pt 2): 131–9.
4. Cunningham-Rundles C. Physiology of IgA and IgA deficiency. J Clin Immunol 2001; 21: 303–9.
5. Woof JM, Kerr MA. The function of immunoglobulin A in immunity. J Pathol 2006; 208: 270–82.
6. Russell MW, Sibley DA, Nikolova EB et al. IgA antibody as a non-inflammatory regulator of immunity. Biochem Soc Trans 1997; 25: 466–70.
7. Corthésy B. Roundtrip ticket for secretory IgA: role in mucosal homeostasis? J Immunol 2007; 178: 27–32.
8. Дранник Г.Н. Клиническая иммунология и аллергология. М.: Медицинское информационное агентство, 2003.
[Drannik G.N. Clinical immunology and allergology. Moscow: Medical News Agency, 2003 (in Russian).]
9. Cerutti A, Rescigno M. The biology of intestinal immunoglobulin A responses. Immunity 2008; 28: 740–50.
10. Bäckhed F, Ley RE, Sonnenburg JL et al. Host-bacterial mutualism in the human intestine. Science 2005; 307: 1915–20.
11. Macpherson AJ, Geuking MB, McCoy KD. Immune responses that adapt the intestinal mucosa to commensal intestinal bacteria. Immunology 2005; 115: 1531–62.
12. Corthésy B. Multi-faceted functions of secretory IgA at mucosal surfaces. Front Immunol 2013; 4: 185.
13. Iankov ID, Petrov DP, Mladenov IV et al. Protective efficacy of IgA monoclonal antibodies to O and H antigens in a mouse model of intranasal challenge with Salmonella enterica serotype enteritidis. Microbes Infect 2004; 6: 901–1010.
14. Phalipon A, Kaufmann M, Michetti P, et al. Monoclonal immunoglobulin A antibody directed against serotype-specific epitope of Shigella flexnerilipopolysaccharide protects against murine experimental shigellosis. J Exp Med 1995; 182: 769–81.
15. Blanchard TG, Czinn SJ, Maurer R et al. Urease-specific monoclonal antibodies prevent Helicobacter felis infection in mice. Infect Immun 1995; 63: 1394–9.
16. Apter FM, Lencer WI, Finkelstein RA et al. Monoclonal immunoglobulin A antibodies directed against cholera toxin prevent the toxin-induced chloride secretory response and block toxin binding to intestinal epithelial cells in vitro. Infect Immun 1993; 61: 5271–8.
17. Stubbe H, Berdoz J, Kraehenbuhl JP, Corthésy B. Polymeric IgA is superior to monomeric IgA and IgG carrying the same variable domain in preventing Clostridium difficile toxin A damaging of T84 monolayers. J Immunol 2000; 164: 1952–60.
18. Mantis NJ, Palaia J, Hessell AJ et al. Inhibition of HIV-1 infectivity and epithelial cell transfer by human monoclonal IgG and IgA antibodies carrying the b12 V region. J Immunol 2007; 179: 3144–52.
19. Perrier C, Sprenger N, Corthésy B. Glycans on secretory component participate in innate protection against mucosal pathogens. J Biol Chem 2006; 281: 14280–7. DOI: 10.1074/jbc.M512958200
20. Boullier S, Tanguy M, Kadaoui KA et al. Secretory IgA-mediated neutralization of Shigella flexneri prevents intestinal tissue destruction by down-regulating inflammatory circuits. J Immunol 2009; 183: 5879–85. DOI: 10.4049/jimmunol.0901838
21. Janzi M, Kull I, Sjöberg R et al. Selective IgA deficiency in early life: association to infections and allergic diseases during childhood. Clin Immunol 2009; 133: 78–85.
22. Zinneman HH, Kaplan AP. The association of giardiasis with reduced intestinal secretory immunoglobulin A. Dig Dis Sci 1975; 125: 207–13.
23. Aghamohammadi A, Cheraghi T, Gharagozlou M et al. IgA deficiency: correlation between clinical and immunological phenotypes. J Clin Immunol 2009; 29: 130–6.
24. Barka N, Shen G-Q, Schonfeld Y et al. Multireactive patterns of serum autoantibodies in asymptomatic individuals with immunoglobulin A deficiency. Clin Diag Lab Immunol 1995; 2: 469–72.
25. Edwards E, Razvi S, Cunningham-Rundles C. IgA deficiency: clinical correlates and responses to pneumococcal vaccine. Clin Immunol 2004; 111: 93–7.
26. Prince HE, Norman GL, Binder WL. Immunoglobulin A (IgA) deficiency and alternative celiac disease-associated antibodies in sera submitted to a reference laboratory for endomysial IgA testing. Clin Diagn Lab Immunol 2000; 7: 192–6.
27. Husby S, Koletzko S, Korponay-Szabo IR et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition Guidelines for the Diagnosis of Coeliac Disease. JPGN 2012; 54: 136–60.
28. Jacob CM, Pastorino AC, Fahl K et al. Autoimmunity in IgA deficiency: revisiting the role of IgA as a silent housekeeper. J Clin Immunol 2008; 28: S56–S61.
Источник: Consilium Medicum