Механизмы пищевой анафилаксии: генетические варианты DPEP1 и терапевтический потенциал зилеутона
Результаты двух независимых исследований, опубликованных в Science, раскрывают новые механизмы, определяющие роль цистеиновых лейкотриенов в патогенезе анафилаксии при пищевой аллергии.
Команда ученых во главе со Стефани Айсенбарт из Северо-Западного университета с использованием сравнительного геномного анализа показала, что предрасположенность к развитию пищевой анафилаксии у мышей связана с генетическими вариантами фермента DPEP1 (dipeptidase 1), разрушающего лейкотриен D4 (LTD4). Активные аллели DPEP1 ускоряют инактивацию LTD4 в кишечнике и уменьшают риск системного ответа. При низкой активности фермента LTD4 накапливается, усиливая сокращение гладких мышц бронхов и повышая вероятность развития анафилактического шока. Эти данные позволяют объяснить различия в тяжести реакций у животных со сходным уровнем IgE.
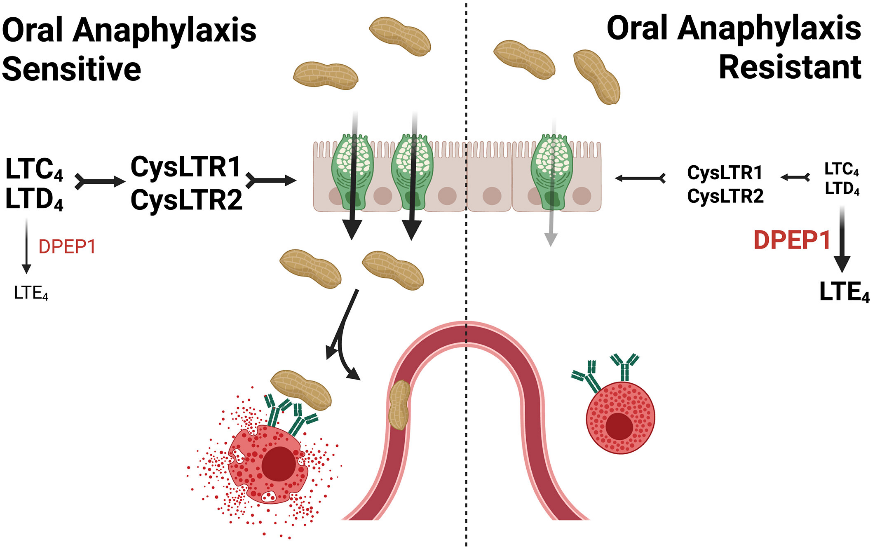
Другая группа ученых под руководством Руслана Меджитова из Медицинского института Говарда Хьюза, также изучала цистеиновые лейкотриены, к которым относится лейкотриен D4.
Они вводили мышам пищевые аллергены и пытались заблокировать выработку лейкотриенов препаратом зилеутон (ингибитор 5-липооксигеназы, применяемый при астме), который ингибирует образование лейкотриенов. Препарат уменьшал проявления аллергии, только если аллергены попадали в организм через пищу. Если же аллергены вводили в кровь, то препарат не имел эффекта.
Тогда были изучены функциональные различия тучных клеток. Сравнительный анализ показал, что энтеральные тучные клетки преимущественно секретируют лейкотриены, тогда как тканевые внекишечные — гистамин. Это объясняет, почему блокада биосинтеза лейкотриенов препаратом зилеутон эффективно предотвращала развитие анафилаксии только при оральном введении аллергена. В модели мышей терапия зилеутоном предотвращала ключевые клинические признаки анафилаксии (гипотермия, сосудистый коллапс).
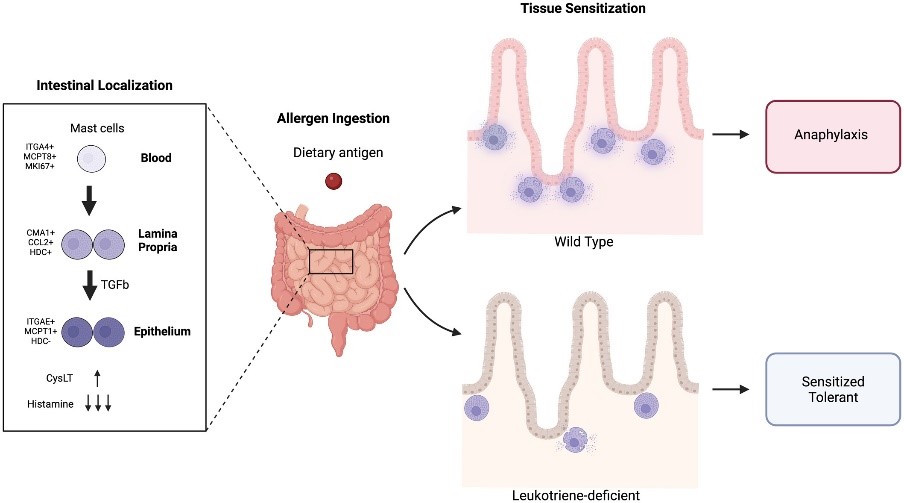
Полученные данные подчеркивают роль цистеиновых лейкотриенов в энтерально-индуцированной анафилаксии и открывают возможность их фармакологической модуляции. Хотя омализумаб остаётся основным биологическим препаратом, доказавшим эффективность при пищевой аллергии, результаты данных работ расширяют потенциальный спектр мишеней терапии — от генетических предикторов риска до таргетной блокады лейкотриенового каскада.
Источник: https://www.science.org/doi/10.1126/science.adp0246